-
Introducción
El estudio de la estructura y propiedades de los materiales es fundamental para la ingeniería y el desarrollo tecnológico. Comprender cómo se clasifican los estados de la materia, las transformaciones que experimentan bajo diversas condiciones y las propiedades físicas, químicas y mecánicas que los caracterizan proporciona la base para predecir y manipular el comportamiento de los materiales en aplicaciones prácticas. Este conocimiento es esencial para la selección y diseño de materiales en una amplia gama de campos, desde la construcción hasta la electrónica avanzada.
Profundizar en la estructura atómica y los enlaces básicos revela los principios subyacentes que gobiernan el comportamiento de los materiales a nivel macroscópico. El análisis de los modelos atómicos, tipos de enlaces y configuraciones electrónicas no solo explica las propiedades observables de los materiales, sino que también abre la puerta a la innovación en el diseño de nuevos materiales con características específicas. Esta comprensión fundamental permite a los ingenieros y científicos desarrollar soluciones más eficientes y sostenibles, abordando desafíos complejos en áreas como la energía, el transporte y la medicina, y sentando las bases para avances tecnológicos futuros.
Termino
Enlace covalente: Tipo de enlace químico caracterizado por la compartición de electrones entre átomos, generalmente no metálicos, para formar moléculas estables.
Termino
Configuración electrónica: corresponde a la distribución de los electrones en los orbitales atómicos de un átomo, siguiendo los principios de la mecánica cuántica y las reglas de llenado de orbitales.
-
2.1. Clasificación de la materia y sus estados
La materia se clasifica principalmente según su composición y estado físico. Esta clasificación es crucial para entender cómo se comportan los materiales en diferentes condiciones.
2.1.1. Estados fundamentales
La materia se presenta comúnmente en tres estados fundamentales (Callister & Rethwisch, 2016; López-Tolentino, 2019):
- Sólido: En este estado, las partículas están estrechamente unidas y mantienen una forma y volumen definidos. Las fuerzas intermoleculares son intensas, limitando el movimiento de las partículas a vibraciones alrededor de posiciones fijas. Los sólidos se caracterizan por su rigidez y resistencia a la deformación. Ejemplos incluyen metales, cerámicas y la mayoría de los polímeros a temperatura ambiente.
- Líquido: Las partículas en estado líquido tienen mayor libertad de movimiento que en los sólidos, pero aún mantienen cierta cohesión. Los líquidos tienen un volumen definido, pero adoptan la forma del recipiente que los contiene. Esta propiedad se debe a que las fuerzas intermoleculares son más débiles que en los sólidos, permitiendo que las moléculas se deslicen unas sobre otras. El agua, el aceite y el mercurio son ejemplos comunes de líquidos.
- Gaseoso: En este estado, las partículas tienen la mayor libertad de movimiento, con fuerzas intermoleculares muy débiles. Los gases no tienen forma ni volumen definidos y tienden a expandirse para ocupar todo el espacio disponible. Las moléculas de gas se mueven rápidamente y colisionan constantemente entre sí y con las paredes del contenedor. El aire que respiramos y el helio en los globos son ejemplos de gases.
Además de estos estados fundamentales, existen estados de la materia menos comunes, pero igualmente importantes en ciertas aplicaciones:
- Plasma: Considerado el cuarto estado de la materia, el plasma es un gas ionizado que contiene una cantidad significativa de partículas cargadas. Se encuentra naturalmente en las estrellas y se utiliza en tecnologías como las pantallas de plasma y en procesos de soldadura.
- Condensados de Bose-Einstein: Este estado de la materia se produce a temperaturas extremadamente bajas, cerca del cero absoluto. En estas condiciones, los átomos pierden su identidad individual y se comportan como una sola entidad cuántica.
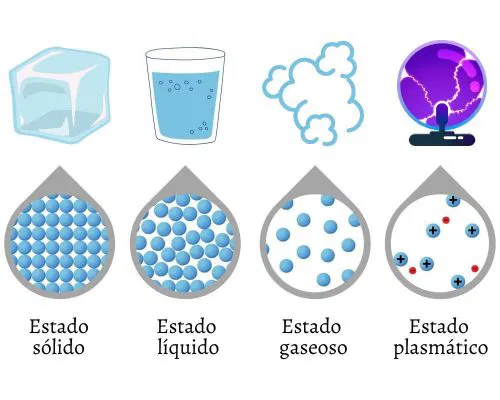
Figura 1: Prueba de Imagen 2.1.2. Cambios de estado
Los cambios de estado ocurren cuando la materia pasa de un estado físico a otro debido a variaciones en la temperatura o presión. Estos procesos son fundamentales en muchos procesos industriales y naturales (Alvarado Lemus et al., 2019):
- Fusión: Paso de sólido a líquido. Ocurre cuando se suministra suficiente energía térmica para superar las fuerzas intermoleculares que mantienen la estructura sólida. Por ejemplo, el hielo fundiéndose a 0°C.
- Solidificación: Paso de líquido a sólido. Es el proceso inverso a la fusión y ocurre cuando se retira energía térmica del sistema. La formación de hielo a partir del agua líquida es un ejemplo común.
- Vaporización: Paso de líquido a gas. Puede ocurrir por ebullición (en toda la masa del líquido) o por evaporación (en la superficie). El agua hirviendo a 100°C es un ejemplo de vaporización.
- Condensación: Paso de gas a líquido. Ocurre cuando el gas pierde energía térmica y las moléculas se acercan lo suficiente para que las fuerzas intermoleculares sean significativas. La formación de gotas de agua en una superficie fría es un ejemplo de condensación.
- Sublimación: Paso directo de sólido a gas sin pasar por el estado líquido. Es común en sustancias como el hielo seco (CO₂ sólido) que sublima a temperatura ambiente.
- Deposición: Paso directo de gas a sólido. Es el proceso inverso a la sublimación y se observa, por ejemplo, en la formación de escarcha en superficies muy frías.
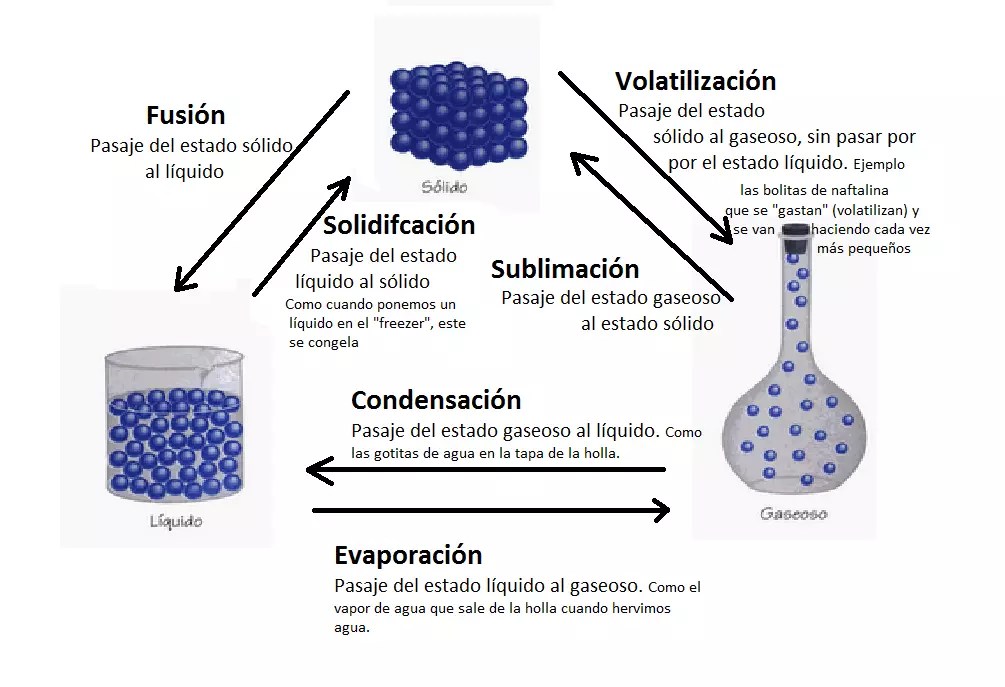
Figura 2. Cambios de estado de la materia
Tomado de (Rhoton, 2023)Estos cambios de estado implican la absorción o liberación de energía, lo que se refleja en las curvas de calentamiento o enfriamiento de las sustancias. La energía asociada a estos cambios se denomina calor latente y es específica para cada material.
2.1.3. Propiedades por estado
Cada estado de la materia presenta propiedades características que determinan su comportamiento y aplicaciones:
- Sólidos:
- Forma y volumen definidos
- Alta densidad
- Baja compresibilidad
- Capacidad de soportar esfuerzos cortantes
- Difusión lenta de partículas
- Expansión térmica generalmente baja
- Conductividad térmica y eléctrica variable según el material
- Líquidos:
- Volumen definido, pero forma variable
- Densidad menor que los sólidos, pero mayor que los gases
- Baja compresibilidad
- Capacidad de fluir
- Tensión superficial
- Viscosidad variable según la temperatura
- Conductividad térmica generalmente menor que los sólidos
- Gases:
- Sin forma ni volumen definidos
- Baja densidad
- Alta compresibilidad
- Capacidad de expansión y difusión
- Ocupan todo el volumen disponible
- Presión ejercida sobre las paredes del contenedor
- Conductividad térmica generalmente baja
Propiedad Sólido Líquido Gaseoso Plasmático Tipo de materia Materia fija Fluidos con viscosidad Gases Gases calientes (con carga eléctrica) Atracción entre partículas Alta Intermedia Baja Baja Movilidad de partículas Baja Intermedia Alta Alta Volumen Con volumen Con volumen Sin volumen Sin volumen Forma Definida Indefinida Indefinida Indefinida Ejemplo Piedras Agua Vapor de agua TV de plasma Tabla 1. Propiedades de la materia por estado
Tomado de (Rhoton, 2023)SólidoTipo de materia: Materia fija
Atracción entre partículas: Alta
Movilidad de partículas: Baja
Volumen: Con volumen
Forma: Definida
Ejemplo: Piedras
LíquidoTipo de materia: Fluidos con viscosidad
Atracción entre partículas: Intermedia
Movilidad de partículas: Intermedia
Volumen: Con volumen
Forma: Indefinida
Ejemplo: Agua
GaseosoTipo de materia: Gases
Atracción entre partículas: Baja
Movilidad de partículas: Alta
Volumen: Sin volumen
Forma: Indefinida
Ejemplo: Vapor de agua
PlasmáticoTipo de materia: Gases calientes (con carga eléctrica)
Atracción entre partículas: Baja
Movilidad de partículas: Alta
Volumen: Sin volumen
Forma: Indefinida
Ejemplo: TV de plasma
-
2.2. Propiedades fundamentales de la materia
Las propiedades de la materia se pueden clasificar en tres categorías principales: físicas, químicas y mecánicas. Estas propiedades determinan el comportamiento y las aplicaciones potenciales de los materiales en diversos campos de la ingeniería y la tecnología.
2.2.1. Propiedades físicas
Las propiedades físicas son aquellas que pueden observarse o medirse sin alterar la composición química de la sustancia. Estas propiedades son cruciales para la caracterización y selección de materiales en aplicaciones específicas (Ruiz Sánchez et al., 2023):
- Densidad: Relación entre la masa y el volumen de un material. Se expresa generalmente en kg/m³ o g/cm³. La densidad es fundamental en aplicaciones donde el peso es un factor crítico, como en la industria aeroespacial.
- Punto de fusión y ebullición: Temperaturas a las que un material cambia de estado sólido a líquido y de líquido a gas, respectivamente. Estos puntos son importantes en procesos de fundición, soldadura y en aplicaciones de alta temperatura.
- Conductividad térmica: Capacidad de un material para conducir calor. Se mide en W/(m·K). Es crucial en el diseño de intercambiadores de calor, aislantes térmicos y en la gestión térmica de dispositivos electrónicos.
- Conductividad eléctrica: Capacidad de un material para conducir corriente eléctrica. Se mide en S/m (Siemens por metro). Esta propiedad es esencial en la fabricación de cables, semiconductores y en aplicaciones electrónicas.
- Propiedades ópticas: Incluyen características como el color, la transparencia y el índice de refracción. Son fundamentales en la industria óptica, en la fabricación de lentes, fibras ópticas y recubrimientos.
- Propiedades magnéticas: Describen cómo un material responde a campos magnéticos externos. Son cruciales en la fabricación de imanes permanentes, núcleos de transformadores y en dispositivos de almacenamiento de datos.
- Coeficiente de expansión térmica: Mide el cambio en las dimensiones de un material con la temperatura. Es importante en el diseño de estructuras y en la selección de materiales para aplicaciones que involucran cambios de temperatura.
- Calor específico: Cantidad de energía necesaria para elevar la temperatura de una unidad de masa del material en un grado. Es relevante en aplicaciones de almacenamiento de energía térmica y en el diseño de sistemas de refrigeración.
2.2.2. Propiedades químicas
Las propiedades químicas se refieren a la capacidad de un material para experimentar cambios que alteran su composición química. Estas propiedades son fundamentales para entender cómo los materiales interactúan con su entorno y cómo se comportan en diferentes condiciones de uso:
- Reactividad: Tendencia de un material a reaccionar químicamente con otras sustancias. La reactividad es crucial en la selección de materiales para aplicaciones donde la estabilidad química es importante, como en la industria química y farmacéutica.
- Estabilidad química: Resistencia de un material a descomponerse o a reaccionar en diferentes condiciones ambientales. Esta propiedad es esencial en la selección de materiales para aplicaciones de larga duración o en ambientes agresivos.
- Corrosión: Deterioro de un material, generalmente metálico, debido a reacciones químicas con su entorno. La resistencia a la corrosión es crucial en aplicaciones marinas, en la industria química y en la construcción.
- Inflamabilidad: Facilidad con la que un material puede encenderse y mantener la combustión. Es una propiedad crítica en la selección de materiales para aplicaciones donde la seguridad contra incendios es primordial.
- Toxicidad: Capacidad de un material para causar daño a organismos vivos. La toxicidad es una consideración importante en la selección de materiales para aplicaciones médicas, en la industria alimentaria y en productos de consumo.
- pH: En el caso de soluciones, indica su acidez o basicidad. Es relevante en procesos químicos, en el tratamiento de aguas y en la industria alimentaria.
- Resistencia a la radiación: Capacidad de un material para mantener sus propiedades cuando se expone a radiación ionizante. Es crucial en aplicaciones nucleares y espaciales.
- Biodegradabilidad: Capacidad de un material para descomponerse naturalmente por acción de microorganismos. Es una propiedad importante en el desarrollo de materiales sostenibles y en la gestión de residuos.
2.2.3. Propiedades mecánicas
Las propiedades mecánicas describen el comportamiento de los materiales cuando se someten a fuerzas externas. Estas propiedades son cruciales en el diseño y selección de materiales para aplicaciones estructurales y de ingeniería:
- Resistencia: Capacidad de un material para soportar cargas sin romperse o deformarse permanentemente. Se puede medir en términos de resistencia a la tracción, compresión, flexión o cizallamiento.
- Elasticidad: Capacidad de un material para recuperar su forma original después de ser deformado. El módulo de Young es una medida cuantitativa de la elasticidad.
- Plasticidad: Capacidad de un material para deformarse permanentemente sin romperse. Es importante en procesos de conformado de metales como la forja y la extrusión.
- Dureza: Resistencia de un material a ser rayado o penetrado por otro. Se mide mediante escalas como Brinell, Rockwell o Vickers.
- Ductilidad: Capacidad de un material para deformarse plásticamente sin romperse. Es crucial en aplicaciones que requieren conformado de metales.
- Tenacidad: Capacidad de un material para absorber energía antes de fracturarse. Es importante en aplicaciones que requieren resistencia al impacto.
- Fatiga: Comportamiento de un material bajo cargas cíclicas repetitivas. La resistencia a la fatiga es crucial en componentes sometidos a cargas variables, como ejes y resortes.
- Fluencia: Deformación lenta y continua de un material bajo carga constante. Es importante en aplicaciones de alta temperatura o carga prolongada.
Estas propiedades se cuantifican mediante diversos ensayos estandarizados, como pruebas de tracción, compresión, flexión, dureza y ensayos de impacto. Los resultados de estos ensayos son fundamentales para la selección de materiales en ingeniería y para predecir el comportamiento de los componentes en servicio.
Aprende más
En el siguiente enlace se puede revisar algunas de estas propiedades a mayor detalle(Rodriguez, 2021): ¡Accede aquí!
-
2.3. Estructura atómica y enlaces básicos
La comprensión de la estructura atómica y los tipos de enlaces es fundamental para explicar las propiedades macroscópicas de los materiales. Esta sección explora los modelos atómicos, los tipos de enlaces químicos y las configuraciones electrónicas que determinan el comportamiento de los materiales a nivel atómico y molecular.
2.3.1. Modelos atómicos
A lo largo de la historia, se han propuesto varios modelos atómicos para explicar la estructura de la materia. Cada modelo ha contribuido a nuestra comprensión actual del átomo,(Marchesi & Custodio, 2023 (Oliveira & Fernandes, 2006):
- Modelo de Dalton (1808): Propuso que la materia está compuesta por partículas indivisibles llamadas átomos. Este modelo sentó las bases de la teoría atómica moderna.
- Modelo de Thomson (1897): Conocido como el modelo de "pudín de pasas", sugirió que los electrones estaban incrustados en una esfera de carga positiva. Este modelo introdujo la idea de que los átomos contenían partículas subatómicas.
- Modelo de Rutherford (1911): Introdujo la idea de un núcleo atómico denso y positivo, con electrones orbitando alrededor. Este modelo se basó en el famoso experimento de dispersión de partículas alfa.
- Modelo de Bohr (1913): Propuso que los electrones orbitan el núcleo en niveles de energía discretos. Este modelo explicó el espectro de emisión del hidrógeno y sentó las bases para la mecánica cuántica.
- Modelo cuántico (1920s en adelante): Describe los electrones como ondas de probabilidad alrededor del núcleo, introduciendo conceptos como orbitales atómicos y números cuánticos. Este modelo, basado en la mecánica cuántica, es el más aceptado actualmente y proporciona una descripción precisa de la estructura electrónica de los átomos.
El modelo cuántico introduce varios conceptos importantes:
- Orbitales atómicos: Regiones del espacio alrededor del núcleo donde es más probable encontrar un electrón.
- Números cuánticos: Describen el estado energético y la configuración espacial de los electrones en un átomo.
- Principio de incertidumbre de Heisenberg: Establece que no es posible conocer simultáneamente y con precisión la posición y el momento de un electrón.
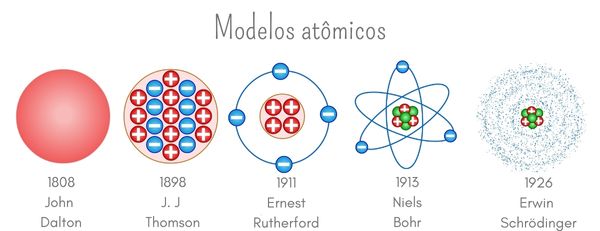
Figura 4. Modelos atómicos
Tomado de (LIMA, 2024)Aprende más
En el siguiente enlace puede realizar un recorrido histórico a través de los modelos atómicos propuestos(Univesp, 2020): ¡Accede aquí!
2.3.2. Tipos de enlaces
Los enlaces químicos son las fuerzas que mantienen unidos a los átomos para formar moléculas y materiales. La naturaleza de estos enlaces determina muchas de las propiedades físicas y químicas de los materiales. Los principales tipos de enlaces son (García, 2014):
- Enlace iónico: Se forma por la transferencia de electrones entre un metal y un no metal. Resulta en la atracción electrostática entre iones de carga opuesta. Ejemplo: NaCl (cloruro de sodio).
- : Implica la compartición de electrones entre átomos no metálicos. Puede ser simple, doble o triple. Ejemplo: H₂O (agua).
- Enlace metálico: Característico de los metales, donde los electrones de valencia forman una "nube" deslocalizada alrededor de los núcleos atómicos positivos.
- Enlaces secundarios: Incluyen fuerzas de Van der Waals y puentes de hidrógeno. Son más débiles que los enlaces primarios pero importantes en muchas propiedades de los materiales.
Características:
- Alta energía de enlace
- Formación de estructuras cristalinas
- Altos puntos de fusión y ebullición
- Conductividad eléctrica en solución o fundidos
Características:
- Formación de moléculas discretas o redes covalentes
- Amplio rango de puntos de fusión y ebullición
- Generalmente baja conductividad eléctrica
- Puede formar estructuras direccionales
Características:
- Alta conductividad eléctrica y térmica
- Maleabilidad y ductilidad
- Brillo metálico
- Generalmente altos puntos de fusión
Características:
- Determinan propiedades como la tensión superficial
- Importantes en la estructura de proteínas y polímeros
- Influyen en puntos de ebullición de sustancias moleculares
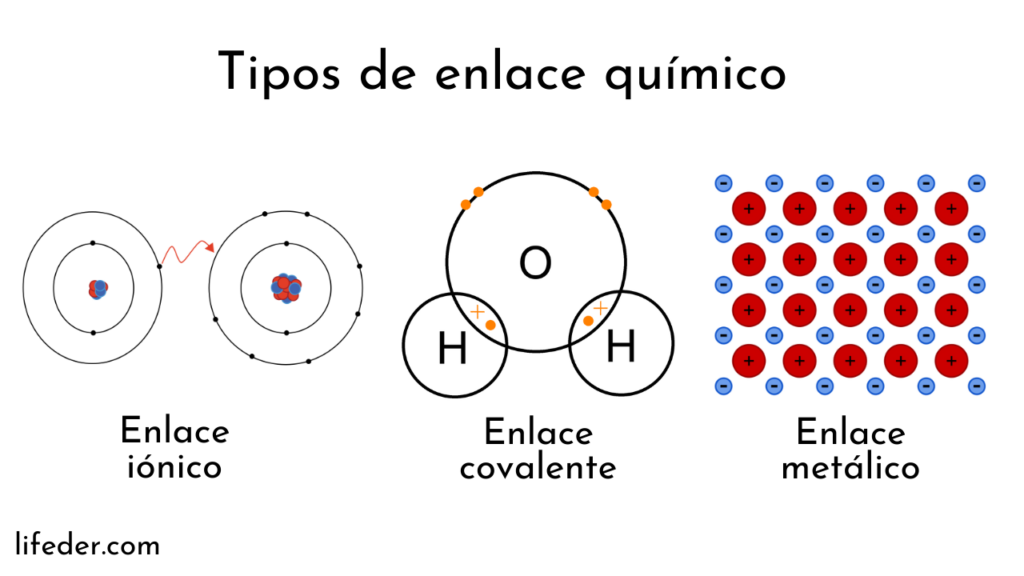
Figura 5. Tipos de enlace químico
Tomado de (Lifeder, 2022)2.3.3. Configuraciones electrónicas
La describe la distribución de los electrones en los orbitales atómicos de un átomo. Esta distribución es fundamental para entender las propiedades químicas de los elementos y cómo forman enlaces (Atkins et al., 2018).
Principios fundamentales:
- Principio de Aufbau: Los electrones ocupan los orbitales de menor energía primero.
- Principio de exclusión de Pauli: Cada orbital puede contener un máximo de dos electrones con espines opuestos.
- Regla de Hund: En orbitales de igual energía, los electrones se distribuyen con el mismo espín antes de aparearse.
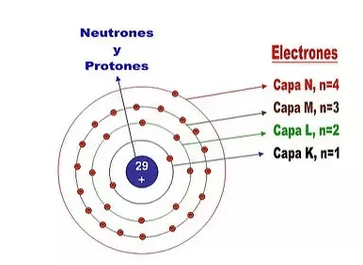
Figura 6. Estructura Electrónica del Átomo de Cobre
Tomado de (García, 2014)La configuración electrónica se escribe utilizando números cuánticos o la notación de capa-subcapa. Por ejemplo, para el carbono (Z=6): 1s² 2s² 2p².
Importancia de la configuración electrónica:
- Determina la valencia y la reactividad química de los elementos
- Explica la periodicidad de las propiedades en la tabla periódica
- Predice el tipo de enlaces que formará un átomo
- Influye en las propiedades magnéticas de los materiales
Ejemplos de configuraciones electrónicas:
- Hidrógeno (Z=1): 1s¹
- Oxígeno (Z=8): 1s² 2s² 2p⁴
- Sodio (Z=11): 1s² 2s² 2p⁶ 3s¹
- Hierro (Z=26): 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁶
La comprensión de las configuraciones electrónicas es crucial para:
- Predecir la formación de compuestos químicos
- Entender las propiedades de los elementos de transición
- Explicar el comportamiento de los semiconductores
- Diseñar nuevos materiales con propiedades específicas
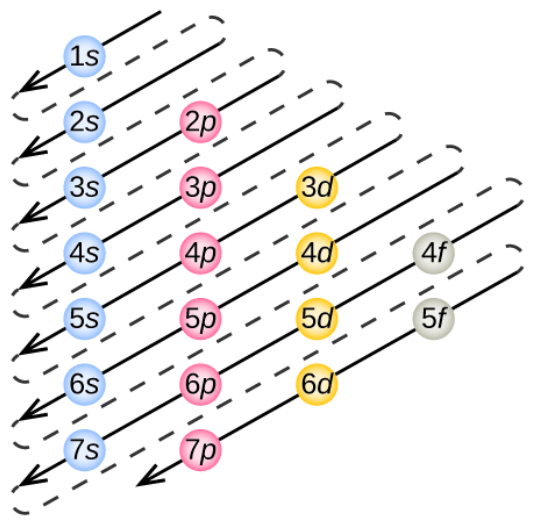
Figura 7. Diagrama de Niveles y Subniveles de Energía en un Átomo
Tomado de (Yepes, 2020)La estructura atómica y los enlaces básicos son fundamentales para comprender las propiedades de los materiales a nivel macroscópico, con los modelos atómicos evolucionando para proporcionar una descripción precisa de la estructura de la materia, mientras que los diferentes tipos de enlaces explican la formación de moléculas y sólidos. La ciencia de los materiales utiliza este conocimiento fundamental para diseñar y desarrollar nuevos materiales con propiedades específicas para diversas aplicaciones en ingeniería y tecnología, desde aleaciones más resistentes hasta materiales inteligentes, siendo la comprensión de la estructura atómica y los enlaces esencial para el avance tecnológico y la innovación en el campo de los materiales.
-
Profundiza más
Este recurso te ayudará a enfatizar sobre el tema ¡Accede aquí!
-
-
-
Hacer un envío