-
Introducción
La estructura de las moléculas constituye un pilar fundamental en el estudio de los materiales, proporcionando la base para comprender cómo los átomos se organizan y se enlazan para formar compuestos con propiedades específicas. Este conocimiento es crucial para los ingenieros y científicos de materiales, ya que permite predecir y manipular las características de los materiales a nivel macroscópico. En esta unidad, se explorarán los principios fundamentales que rigen la formación de enlaces químicos y moleculares, desde los fuertes enlaces primarios hasta las sutiles que influyen en el comportamiento de la materia.
A medida que se profundiza en las configuraciones moleculares básicas, se analiza cómo la geometría molecular, la polaridad y las estructuras cristalinas determinan las propiedades físicas y químicas de los materiales. Este estudio no solo es esencial para comprender los materiales existentes, sino que también sienta las bases para el diseño y desarrollo de nuevos materiales con características específicas para aplicaciones avanzadas en ingeniería. La comprensión de estos conceptos permitirá a los estudiantes desarrollar una visión integral de la relación entre la estructura atómica y molecular y el comportamiento macroscópico de los materiales, una habilidad indispensable para futuros profesionales en el campo de la ciencia e ingeniería de materiales.
Termino
Estructura Molecular: Es la disposición tridimensional de los átomos en una molécula, determinada por la naturaleza de los enlaces químicos y la repulsión entre pares de electrones de valencia, lo que define sus propiedades físicas y químicas.
Termino
Fuerzas Intermoleculares: Son interacciones débiles entre moléculas que influyen en propiedades macroscópicas como el punto de fusión, la solubilidad y la tensión superficial, siendo esenciales para la estabilidad y comportamiento de los materiales.
-
3.1. Enlaces químicos y moleculares
La estructura de las moléculas es un concepto fundamental en la ciencia de los materiales, ya que esta determina las propiedades físicas, químicas, eléctricas y mecánicas de estos. Para un ingeniero de materiales, comprender la es esencial para diseñar y desarrollar materiales con características específicas para diversas aplicaciones. Esta sección explorará los principios que rigen la formación de enlaces químicos y las configuraciones moleculares resultantes, proporcionando una base sólida para el estudio avanzado de los materiales.
3.1. Enlaces químicos y moleculares
Los enlaces químicos son las fuerzas que mantienen unidos a los átomos para formar moléculas y compuestos. Estos enlaces son el resultado de la interacción de los electrones de valencia de los átomos, y su naturaleza determina en gran medida las propiedades físicas y químicas de los materiales. La energía de un enlace químico influye directamente en la estabilidad de una molécula y, por ende, en su comportamiento en diversas condiciones.
3.1.1. Enlaces primarios
Los enlaces primarios son las interacciones más fuertes entre átomos y se clasifican en tres tipos principales: iónico, covalente y metálico. Cada tipo de enlace primario tiene características distintas y se presenta en diferentes tipos de materiales (Salas–Banuet & Ramírez–Vieyra, 2010; Toletino, 2022).
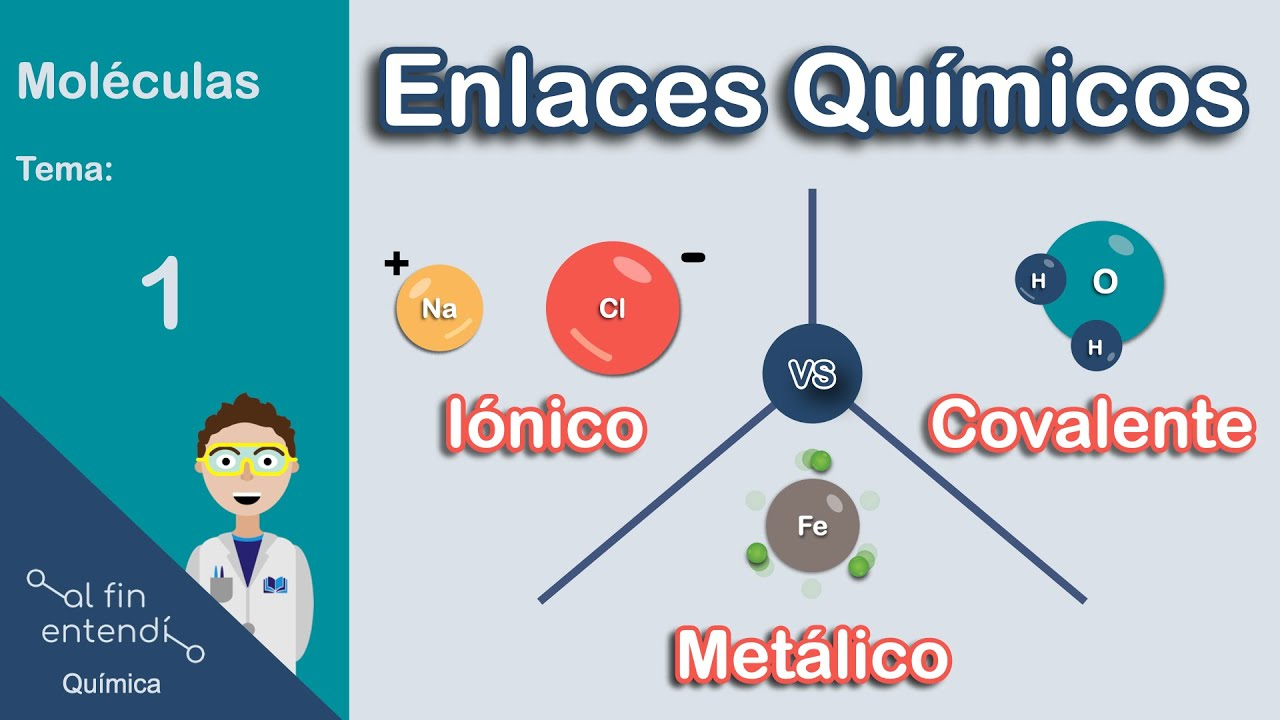
Figura 1. Tipos de enlace primario
Tomado de (Rodriguez, 2021)a) Enlace iónico
El enlace iónico se forma por la transferencia de electrones entre átomos con diferencias significativas de electronegatividad. Este proceso resulta en la formación de iones con cargas opuestas que se atraen electrostáticamente. La fuerza de atracción electrostática es proporcional a la carga de los iones e inversamente proporcional al cuadrado de la distancia entre ellos, como describe la Ley de Coulomb.
Ejemplo: En el cloruro de sodio (NaCl), el sodio (Na) cede un electrón al cloro (Cl), formando iones Na+ y Cl-. La fuerte atracción electrostática entre estos iones resulta en la formación de una red cristalina estable, característica de los compuestos iónicos. Los compuestos iónicos suelen ser duros, quebradizos y tienen altos puntos de fusión debido a la fuerte energía reticular.
b) Enlace covalente
El enlace covalente implica la compartición de electrones entre átomos, generalmente no metálicos, para alcanzar una configuración electrónica estable. Los enlaces covalentes pueden ser simples (compartición de un par de electrones), dobles (compartición de dos pares de electrones) o triples (compartición de tres pares de electrones). La naturaleza del enlace covalente influye en la geometría molecular y en la polaridad de la molécula.
Ejemplo: En la molécula de agua (H2O), cada átomo de hidrógeno comparte un par de electrones con el átomo de oxígeno. El oxígeno, al ser más electronegativo que el hidrógeno, atrae los electrones compartidos hacia sí, creando una distribución desigual de la carga y formando una molécula polar. Esta polaridad es responsable de muchas de las propiedades únicas del agua, como su capacidad para actuar como solvente universal y su alto punto de ebullición.
c) Enlace metálico
El enlace metálico se presenta en metales puros y aleaciones, donde los electrones de valencia forman una "nube" deslocalizada alrededor de los núcleos atómicos positivos. Esta "nube" de electrones permite que los electrones se muevan libremente a través de la estructura del metal, lo que proporciona conductividad eléctrica y térmica.
Ejemplo: En el cobre (Cu), los electrones de valencia se mueven libremente entre los átomos, facilitando el transporte de carga eléctrica y calor. Esta propiedad hace que el cobre sea un material ampliamente utilizado en la fabricación de cables eléctricos y componentes electrónicos. Además, la capacidad de los átomos metálicos para deslizarse unos sobre otros sin romper los enlaces explica la ductilidad y maleabilidad de los metales.
Aprende más
Para más detalles de los tipos de enlaces se puede revisar el siguiente artículo ¡Accede aquí!
3.1.2. Enlaces secundarios
Los enlaces secundarios, también conocidos como fuerzas intermoleculares, son más débiles que los enlaces primarios, pero juegan un papel crucial en las propiedades de muchos materiales, especialmente en estado líquido y sólido. Estos enlaces influyen en las interacciones entre moléculas y determinan propiedades como el punto de fusión, el punto de ebullición y la solubilidad (Cebula et al., 2023; Israelachvili, 2011; Sánchez-Lazo Pérez et al., 2015).
a) Fuerzas de van der Waals
Estas fuerzas débiles se presentan entre todas las moléculas y átomos, y se dividen en tres tipos: fuerzas de dispersión (London), fuerzas dipolo-dipolo y fuerzas de inducción.
- Fuerzas de dispersión (London): Surgen de fluctuaciones momentáneas en la distribución de carga electrónica, creando dipolos instantáneos que inducen dipolos en moléculas vecinas. Estas fuerzas son más significativas en moléculas grandes con muchos electrones.
- Fuerzas dipolo-dipolo: Actúan entre moléculas polares, donde la región positiva de una molécula atrae la región negativa de otra. La magnitud de estas fuerzas depende de la polaridad de la molécula.
- Fuerzas de inducción: Ocurren cuando una molécula polar induce un dipolo en una molécula no polar cercana, creando una atracción entre las dos moléculas.
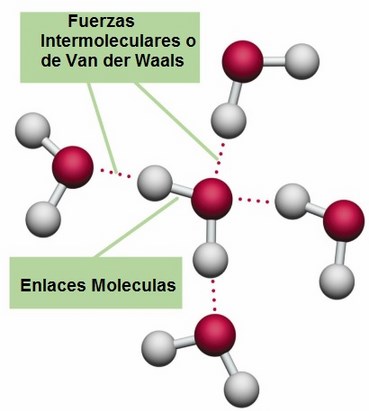
Figura 2. Ilustración de las fuerzas de Van der Waals
Tomado de (Areaciencias, 2024)b) Puentes de hidrógeno
Los puentes de hidrógeno son un tipo especial de interacción dipolo-dipolo que ocurre entre un átomo de hidrógeno unido a un átomo electronegativo (como O, N o F) y otro átomo electronegativo. Estos enlaces son más fuertes que las fuerzas de van der Waals y tienen un impacto significativo en las propiedades de los materiales.
Ejemplo: En el agua líquida, los puentes de hidrógeno entre moléculas de H2O contribuyen a su alto punto de ebullición y otras propiedades únicas. La capacidad del agua para formar puentes de hidrógeno también es fundamental para la estructura y función de las proteínas y el ADN en los sistemas biológicos.
3.1.3. Fuerzas intermoleculares
Las fuerzas intermoleculares, aunque más débiles que los enlaces primarios, son cruciales para determinar muchas propiedades físicas de los materiales, como puntos de fusión y ebullición, solubilidad y tensión superficial. Estas fuerzas influyen en cómo las moléculas interactúan entre sí y, por lo tanto, en el comportamiento macroscópico del material (Fornaso et al., 2018; LibreTexts, 2024; Torres et al., 2010).
a) Importancia en las propiedades de los materiales
Las fuerzas intermoleculares influyen significativamente en:
- Estados de agregación: Determinan si un material es sólido, líquido o gaseoso a temperatura ambiente. Materiales con fuertes fuerzas intermoleculares tienden a ser sólidos o líquidos a temperatura ambiente, mientras que aquellos con fuerzas débiles tienden a ser gases.
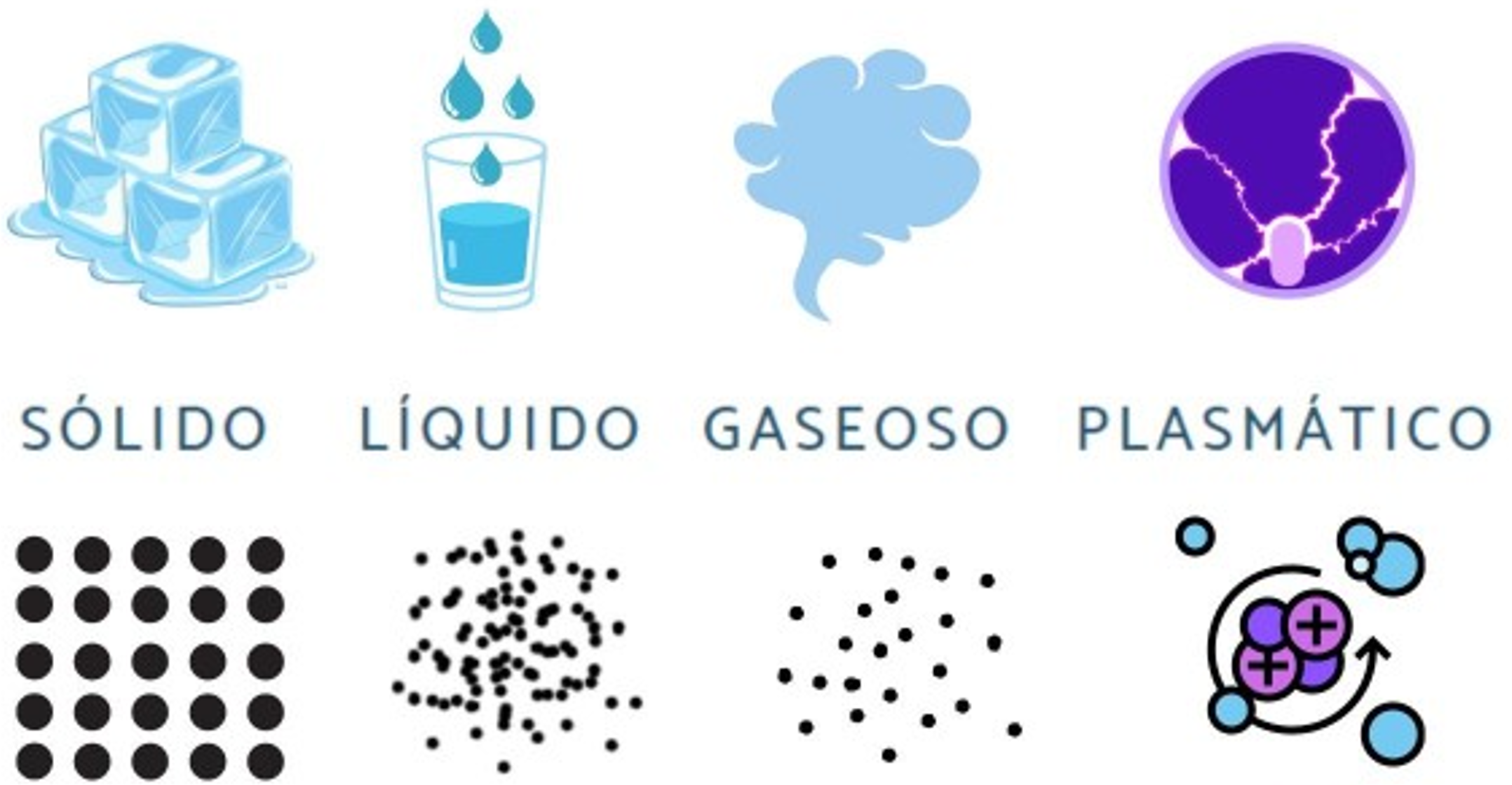
Figura 3. Estados de la materia
Tomado de (Carney, 2015)- Solubilidad: Afectan la capacidad de un material para disolverse en diferentes solventes. La regla general es que "lo similar disuelve a lo similar", lo que significa que moléculas polares se disuelven en solventes polares y moléculas no polares se disuelven en solventes no polares.
- Adsorción: Influyen en la capacidad de los materiales para adherirse a superficies. Las fuerzas intermoleculares entre las moléculas de un material y las de una superficie determinan la fuerza de adhesión.
b) Relación con la estructura molecular
La fuerza y el tipo de interacciones intermoleculares dependen de la estructura y composición de las moléculas:
- Moléculas polares: Tienden a formar interacciones dipolo-dipolo más fuertes. La presencia de grupos funcionales polares, como -OH, -NH2 o -COOH, aumenta la polaridad de la molécula y, por lo tanto, la fuerza de las interacciones intermoleculares.
- Moléculas con grupos -OH, -NH o -F: Pueden formar puentes de hidrógeno. Estos grupos son capaces de formar enlaces de hidrógeno con otras moléculas que contengan átomos electronegativos como oxígeno, nitrógeno o flúor.
- Moléculas grandes: Generalmente presentan fuerzas de dispersión más significativas debido al mayor número de electrones. Las fuerzas de dispersión aumentan con el tamaño y la forma de la molécula.
-
3.2. Configuraciones moleculares básicas
La configuración molecular se refiere a la disposición espacial de los átomos en una molécula, lo cual influye directamente en sus propiedades y reactividad. La configuración molecular es determinada por la naturaleza de los enlaces químicos y por la repulsión entre los pares de electrones de valencia.
3.2.1. Geometría molecular
La geometría molecular está determinada por la disposición tridimensional de los átomos en una molécula. La teoría de repulsión de pares de electrones de la capa de valencia (TRPECV) es fundamental para predecir estas geometrías. Esta teoría establece que los pares de electrones de valencia (tanto enlazantes como no enlazantes) se repelen entre sí y, por lo tanto, se disponen alrededor del átomo central de manera que minimicen esta repulsión (Martínez et al., 2012).
a) Principales geometrías moleculares
- Lineal: Dos átomos unidos a un átomo central (ej. CO2). El ángulo de enlace es de 180 grados.
- Angular: Dos átomos unidos a un átomo central con un ángulo menor a 180° (ej. H2O). La presencia de pares de electrones no enlazantes en el átomo central provoca una mayor repulsión y reduce el ángulo de enlace.
- Trigonal plana: Tres átomos unidos a un átomo central en un plano (ej. BF3). El ángulo de enlace es de 120 grados.
- Tetraédrica: Cuatro átomos unidos a un átomo central (ej. CH4). El ángulo de enlace es de 109.5 grados.
- Piramidal trigonal: Tres átomos unidos a un átomo central con un par solitario (ej. NH3). La presencia del par solitario reduce el ángulo de enlace a aproximadamente 107 grados.
- Octaédrica: Seis átomos unidos a un átomo central (ej. SF6). El ángulo de enlace es de 90 grados.
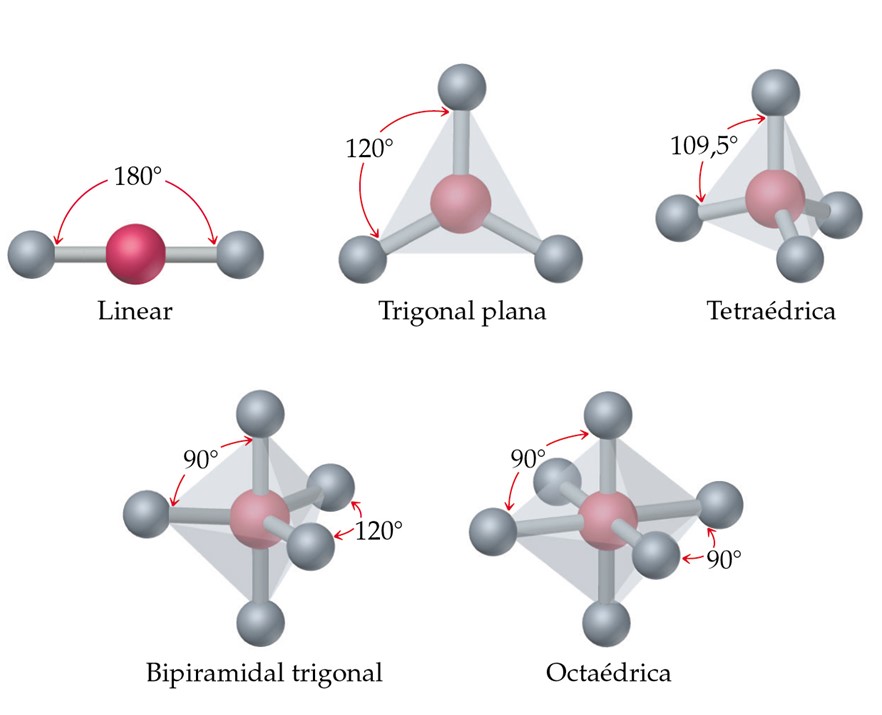
Figura 4. Geometría molecular
Tomado de (descomplica blog, 2022)b) Influencia en las propiedades
La geometría molecular afecta directamente:
- Polaridad de la molécula: La geometría molecular influye en la distribución de los dipolos de enlace y, por lo tanto, en la polaridad general de la molécula.
- Reactividad química: La geometría molecular determina la accesibilidad de los átomos a los reactivos y, por lo tanto, influye en la reactividad de la molécula.
- Propiedades físicas como punto de fusión y ebullición: La geometría molecular afecta las interacciones intermoleculares y, por lo tanto, influye en las propiedades físicas de la sustancia.
3.2.2. Polaridad
La polaridad molecular es el resultado de la distribución desigual de la carga eléctrica en una molécula, lo que tiene implicaciones significativas en las propiedades de los materiales. La polaridad de una molécula depende de la polaridad de los enlaces individuales y de la geometría molecular (Torres et al., 2010; Val Castillo, 2024).
a) Momento dipolar
El momento dipolar es una medida cuantitativa de la polaridad de una molécula. Se calcula como el producto de la carga parcial (δ) y la distancia (d) entre los centros de carga positiva y negativa: . El momento dipolar es un vector que apunta desde la carga negativa hacia la carga positiva.
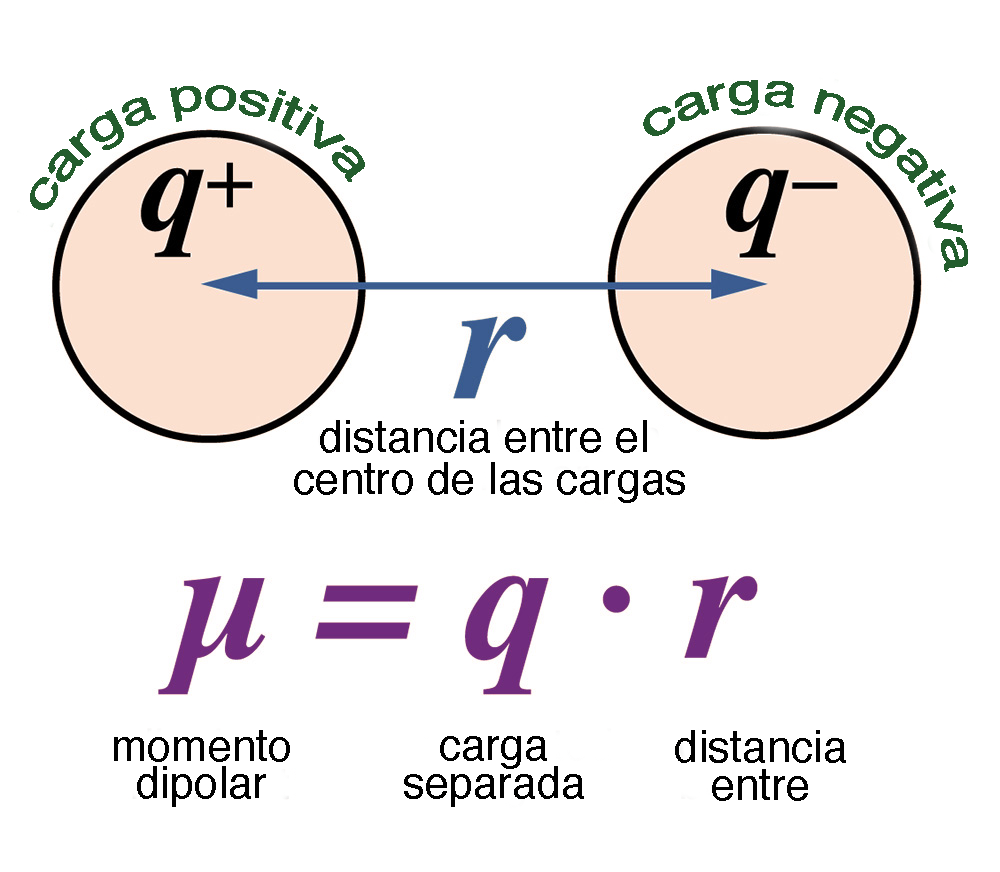
Figura 5. Definición base del momento dipolar
Tomado de (Ponce, 2021)b) Factores que afectan la polaridad
- Electronegatividad de los átomos: La diferencia de electronegatividad entre los átomos en un enlace determina la polaridad del enlace.
- Geometría molecular: La geometría molecular determina cómo se suman los momentos dipolares de los enlaces individuales. Si los momentos dipolares se cancelan, la molécula es no polar, si los momentos dipolares se suman, la molécula es polar.
- Presencia de pares de electrones no compartidos: Los pares de electrones no compartidos en el átomo central contribuyen al momento dipolar de la molécula.
c) Consecuencias de la polaridad
- Solubilidad: las moléculas polares tienden a disolverse en solventes polares, y las moléculas no polares tienden a disolverse en solventes no polares.
- Punto de ebullición: los compuestos polares suelen tener puntos de ebullición más altos debido a las fuertes interacciones dipolo-dipolo entre las moléculas.
- Fuerzas intermoleculares: la polaridad influye en la fuerza de las interacciones entre moléculas.
3.2.3. Estructuras cristalinas
Las estructuras cristalinas son arreglos ordenados y periódicos de átomos, iones o moléculas en un sólido. Estas estructuras son fundamentales para entender las propiedades de muchos materiales, especialmente metales y cerámicos. La estructura cristalina de un material influye en sus propiedades mecánicas, térmicas, eléctricas y ópticas (Meléndez, 2021; Oishi-Tomiyasu, 2024; Paneque-quevedo, 2015).
a) Redes de Bravais
Las redes de Bravais son los 14 arreglos tridimensionales posibles de puntos en el espacio que describen la estructura cristalina de un material. Cada red de Bravais se caracteriza por su tipo de celda unitaria y por las relaciones entre los parámetros de la red (longitudes de los lados y ángulos entre los ejes). Las redes de Bravais más comunes son:
- Cúbica simple (SC): Los átomos están ubicados en las esquinas de un cubo.
- Cúbica centrada en el cuerpo (BCC): Los átomos están ubicados en las esquinas y en el centro del cubo.
- Cúbica centrada en las caras (FCC): Los átomos están ubicados en las esquinas y en el centro de cada cara del cubo.
- Hexagonal compacta (HCP): Los átomos están ubicados en las esquinas y en el centro de las caras hexagonales, así como en el centro del prisma hexagonal.
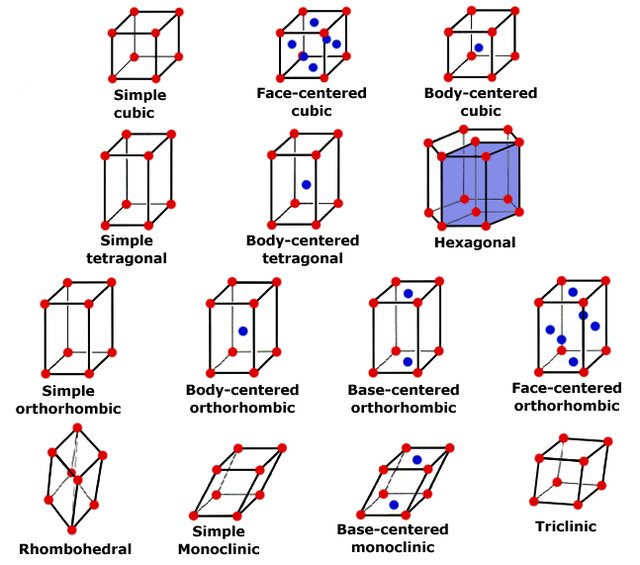
Figura 6. Representación esquemática de las diferentes redes de Bravais que se encuentran en la naturaliza
Tomado de (Marçal, 2015)b) Índices de Miller
Los índices de Miller (hkl) son un sistema de notación utilizado para describir los planos y direcciones en las estructuras cristalinas. Los índices de Miller se determinan identificando las intersecciones del plano con los ejes cristalográficos y tomando los inversos de estos valores. Los índices de Miller son fundamentales para entender la difracción de rayos X y otras técnicas de caracterización de materiales.
c) Defectos cristalinos
Los defectos en la estructura cristalina pueden tener un impacto significativo en las propiedades de los materiales. Los defectos cristalinos se clasifican en:
- Defectos puntuales: Vacantes (ausencia de un átomo en una posición de la red) e intersticiales (átomos adicionales en posiciones no regulares de la red).
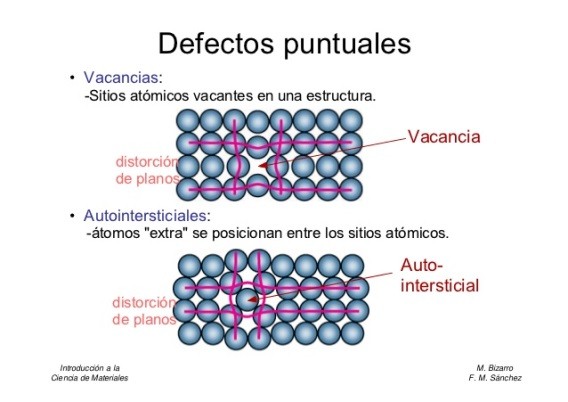
Figura 7. Representación esquemática de las diferentes redes de Bravais que se encuentran en la naturaliza
Tomado de (Paton, 2018)- Defectos lineales: Dislocaciones (defectos lineales que afectan la disposición de los átomos). Las dislocaciones permiten la deformación plástica de los metales.
- Defectos superficiales: Bordes de grano y superficies externas.
d) Importancia en las propiedades de los materiales
La estructura cristalina influye en:
- Propiedades mecánicas: Resistencia, ductilidad, dureza.
- Propiedades térmicas: Conductividad térmica, punto de fusión.
- Propiedades eléctricas: Conductividad eléctrica, semiconductividad.
- Propiedades ópticas: Transparencia, refracción.
Aprende más
Para una mejor revisión de algunos de estos conceptos se puede revisar el siguiente video, (Salvador FI, 2020): ¡Accede aquí!
La comprensión de la estructura de las moléculas, desde los enlaces químicos hasta las configuraciones moleculares y las estructuras cristalinas, es fundamental para el estudio de los materiales. Estos conceptos proporcionan la base para entender cómo las propiedades microscópicas de los átomos y moléculas se traducen en las propiedades macroscópicas de los materiales que observamos y utilizamos en aplicaciones de ingeniería. El dominio de estos principios permite a los ingenieros y científicos de materiales diseñar y desarrollar nuevos materiales con propiedades específicas para diversas aplicaciones tecnológicas.
-
Profundiza más
Este recurso te ayudará a enfatizar sobre el tema ¡Accede aquí!
-
-
-
Make a submission
-
Make attempts: 1
-
-
Make a submission
-
Make attempts: 1