-
Introducción
La transformación de la materia constituye un eje central en la Ciencia de los Materiales, permitiendo comprender la modificación y adaptación de materiales para aplicaciones de ingeniería. Se abordarán los procesos que gobiernan los cambios físicos y químicos, junto con los métodos y variables involucradas en la transformación de materiales. El estudio de estos fenómenos resulta esencial para el ingeniero, al proporcionar el conocimiento base para el diseño, la optimización de procesos industriales y el desarrollo de nuevos materiales con propiedades específicas.
Se explorarán los diferentes tipos de transformaciones físicas y reacciones químicas básicas que experimentan los materiales, analizando el papel de la energía en estos procesos. Se examinarán los métodos de transformación de materiales, las variables del proceso y las estrategias para su control. El objetivo principal es que el estudiante experimente con la materia para conocer sus propiedades y estructura, estableciendo las bases para futuros análisis en el campo de los materiales y su aplicación en la ingeniería.
Termino
Cambio de Estado: Es la transformación física en la que un material pasa de un estado de agregación (sólido, líquido o gas) a otro debido a variaciones de temperatura o presión, sin alterar su composición química.
Termino
Deformación Plástica: Es el cambio permanente en la forma o tamaño de un material cuando se aplica una fuerza que supera su límite elástico, impidiendo que recupere su forma original una vez que la fuerza es retirada.
-
4.1 Cambios físicos y químicos
Los materiales, al interactuar con su entorno o al ser sometidos a diferentes condiciones externas, pueden experimentar transformaciones que afectan sus propiedades o su composición. Estas transformaciones se clasifican en dos categorías principales: cambios físicos y cambios químicos. Comprender estas transformaciones es esencial en la ingeniería de materiales, ya que permite predecir el comportamiento de los materiales en aplicaciones específicas y diseñar procesos industriales eficientes (Angela, 2014; González-felipe et al., 2017; Sanjuan et al., 2014; Wilson et al., 2020).
4.1.1 Tipos de transformaciones físicas
Un cambio físico se caracteriza por no alterar la composición química del material, aunque puede modificar sus propiedades físicas, estructura o estado de agregación. Estas transformaciones son generalmente reversibles y no implican la formación de nuevas sustancias. A continuación, se describen los principales tipos de transformaciones físicas.
a) Cambios de estado
Los cambios de estado son transiciones entre las fases sólida, líquida y gaseosa de un material debido a variaciones en la temperatura o presión. Estas transiciones están regidas por principios termodinámicos como la energía libre de Gibbs (), que determina si un cambio es espontáneo bajo ciertas condiciones (G. Sánchez, 2016).
- Fusión: Es el proceso mediante el cual un sólido pasa al estado líquido al alcanzar su punto de fusión. Durante la fusión, las partículas del material adquieren suficiente energía térmica para superar las fuerzas intermoleculares que las mantienen en una estructura rígida. Por ejemplo, el hielo se funde a 0 °C bajo presión atmosférica estándar.
- Solidificación: Proceso inverso a la fusión, donde un líquido se convierte en sólido al liberar calor latente. Este fenómeno es crucial en procesos industriales como la fundición de metales, donde el control de la solidificación afecta directamente las propiedades mecánicas del material final.
- Vaporización: Es la transición de líquido a gas y puede ocurrir por ebullición (a una temperatura específica) o por evaporación (en cualquier temperatura). La vaporización requiere energía para romper las fuerzas intermoleculares del líquido.
- Condensación: Proceso inverso a la vaporización, donde un gas se convierte en líquido al perder energía térmica. Este fenómeno es utilizado en sistemas de refrigeración y condensadores industriales.
- Sublimación: Cambio directo de sólido a gas sin pasar por el estado líquido. Un ejemplo común es el dióxido de carbono sólido (hielo seco), que sublima a temperatura ambiente.
- Deposición: Proceso inverso a la sublimación, donde un gas se transforma directamente en sólido. Este fenómeno ocurre en la formación de escarcha sobre superficies frías.
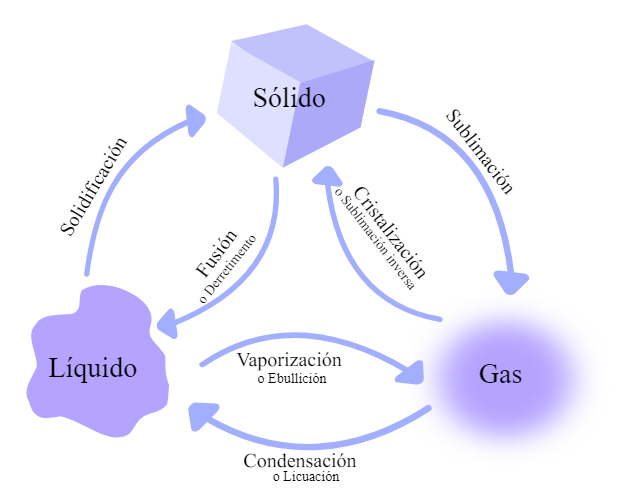
Figura 1. Cambios de estado de la materia
Tomado de (Cabello, 2022)Aprende más
Para una revisión más detallada de estas definiciones se sugiere revisar el siguiente video: ¡Accede aquí!
b) Deformaciones mecánicas
Las deformaciones mecánicas son cambios en la forma o tamaño de un material debido a la aplicación de fuerzas externas. Estas deformaciones pueden clasificarse como elásticas o plásticas (Lubarda & Lee, 1981):
- Deformación elástica: Es reversible; el material recupera su forma original al eliminarse la fuerza aplicada. Este comportamiento está descrito por la ley de Hooke (), donde es el esfuerzo aplicado, E es el módulo de elasticidad del material y es la deformación resultante.
- : es permanente; el material no recupera su forma original después de eliminarse la fuerza aplicada. Este tipo de deformación ocurre cuando el esfuerzo supera el límite elástico del material.
Ejemplos comunes incluyen:
- Estiramiento: Alargamiento del material bajo una fuerza tensil.
- Compresión: Reducción del volumen del material bajo una fuerza compresiva.
- Torsión: Rotación del material sobre su eje debido a un momento torsional.
- Flexión: Curvatura del material bajo una carga perpendicular.
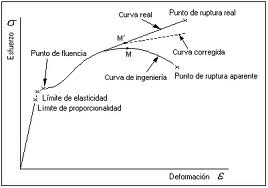
Figura 2. Comportamiento mecánico típico de un material
Tomado de (Popov, 2000; Pytel & Singer, 1994)c) Cambios en la estructura cristalina
En materiales cristalinos, como los metales y algunos cerámicos, pueden ocurrir cambios en la estructura cristalina sin alterar su composición química. Estos cambios afectan propiedades como la dureza, ductilidad y resistencia mecánica.
- Recristalización: Es un proceso mediante el cual se forman nuevos granos cristalinos libres de defectos después de una deformación plástica severa. Este fenómeno ocurre durante tratamientos térmicos específicos y mejora las propiedades mecánicas del material.
- Transformaciones alotrópicas: Algunos materiales pueden existir en diferentes estructuras cristalinas dependiendo de las condiciones externas (como temperatura o presión). Un ejemplo clásico es el hierro, que presenta una transformación alotrópica entre las fases α (ferrita) y γ (austenita) al variar la temperatura.
4.1.2 Reacciones químicas básicas
A diferencia de los cambios físicos, las reacciones químicas implican una alteración en la composición molecular o atómica del material, resultando en la formación de nuevas sustancias con propiedades diferentes. Estas reacciones son fundamentales para sintetizar nuevos materiales o modificar las propiedades existentes.
a) Oxidación-reducción (Redox)
Las reacciones redox involucran la transferencia electrónica entre especies químicas. En estas reacciones:
- La oxidación implica pérdida de electrones.
- La reducción implica ganancia de electrones.
Un ejemplo común es la corrosión del hierro:
La corrosión representa un problema crítico en ingeniería debido al deterioro estructural que causa en componentes metálicos.
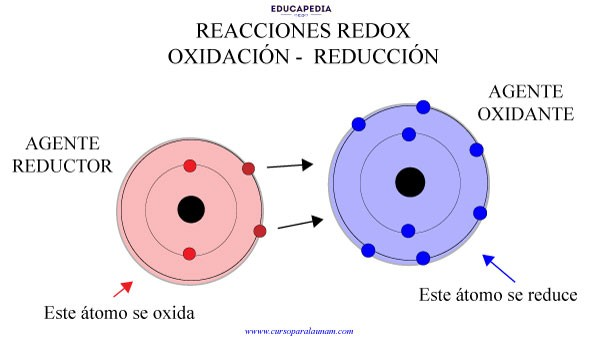
Figura 3. Reacciones redox donde una molécula pierde electrones y otra los toma
Tomado de (Hoyos, 2020)b) Reacciones ácido-base
Estas reacciones involucran transferencia protónica () entre especies químicas según las teorías ácido-base (Arrhenius, Brønsted-Lowry o Lewis). Un ejemplo típico es:
Estas reacciones son fundamentales en procesos como neutralización química y síntesis industrial.
c) Reacciones de precipitación
En estas reacciones se forma un sólido insoluble (precipitado) al mezclar dos soluciones que contienen iones reactivos:
Las reacciones de precipitación son esenciales para purificar compuestos químicos y producir materiales cerámicos.
d) Polimerización
La polimerización es un proceso químico mediante el cual moléculas pequeñas (monómeros) se unen para formar cadenas largas llamadas polímeros. Existen dos tipos principales:
- Polimerización por adición: Los monómeros se enlazan sin pérdida de átomos.
- Polimerización por condensación: Los monómeros reaccionan eliminando moléculas pequeñas como agua o amoníaco.
Este proceso es fundamental para fabricar plásticos como polietileno y nailon.
4.1.3 Energía en las transformaciones
La energía juega un papel crucial tanto en los cambios físicos como en las reacciones químicas (Lubarda & Lee, 1981; G. Sánchez, 2016).
a) Calor latente y calor sensible
En los cambios físicos, como los cambios de estado, se requiere energía para romper o formar enlaces intermoleculares:
- El calor latente es la energía necesaria para cambiar el estado sin alterar la temperatura.
- El calor sensible es el calor necesario para cambiar la temperatura sin cambiar el estado.
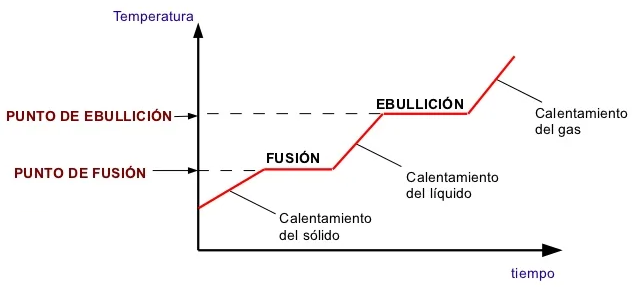
Figura 4. Grafica de
Tomado de (J. Sánchez, 2012)b) Energía de activación
En las reacciones químicas, existe una barrera energética que debe superarse para que ocurra una reacción; esta barrera se conoce como energía de activación (). Los catalizadores son sustancias que reducen , acelerando así las reacciones sin consumirse durante el proceso.
c) Entalpía y entropía
La espontaneidad de una reacción química depende del balance entre la entalpía () y la entropía (), descrito por la ecuación:
Donde representa el cambio en energía libre de Gibbs; si , el proceso es espontáneo.
-
4.2 Procesos de transformación de materiales
Los procesos de transformación de materiales son métodos industriales diseñados para modificar las propiedades físicas, químicas o la forma de los materiales, adaptándolos a aplicaciones específicas. Estos procesos son fundamentales en la fabricación de productos de ingeniería y en la optimización de las propiedades de los materiales para cumplir con requisitos específicos de rendimiento, (Angela, 2014; Ballesteros, 2006; Morgan, 2024; Muñoz et al., 2010).
4.2.1 Métodos de transformación
Los métodos de transformación se pueden clasificar en varias categorías principales, cada una con sus propias características y aplicaciones.
a) Procesos térmicos
Los procesos térmicos implican el uso controlado de calor para modificar la estructura y propiedades de los materiales.
i. Tratamientos térmicos
Los tratamientos térmicos son procesos que alteran las propiedades de los materiales, especialmente metales y aleaciones, mediante ciclos controlados de calentamiento y enfriamiento. Algunos ejemplos clave incluyen (Canale et al., 2008; La et al., 2019):
- Recocido: Proceso que implica calentar el material a una temperatura específica, mantenerlo a esa temperatura durante un tiempo determinado y luego enfriarlo lentamente. El recocido se utiliza para aumentar la ductilidad, reducir la dureza y eliminar tensiones internas.
- Temple: Consiste en calentar el material a una temperatura elevada y luego enfriarlo con rapidez, generalmente en agua o aceite. Este proceso aumenta la dureza y resistencia del material, pero puede reducir su ductilidad.
- Revenido: Se aplica después del temple para reducir la fragilidad. Implica calentar el material templado a una temperatura inferior a la crítica, mantenerlo y luego enfriarlo. El revenido permite ajustar el equilibrio entre dureza y ductilidad.
La ecuación de Hollomon-Jaffe describe la relación entre tiempo y temperatura en tratamientos térmicos:
Donde P es el parámetro de Hollomon-Jaffe, T es la temperatura absoluta, C es una constante específica del material, y t es el tiempo.
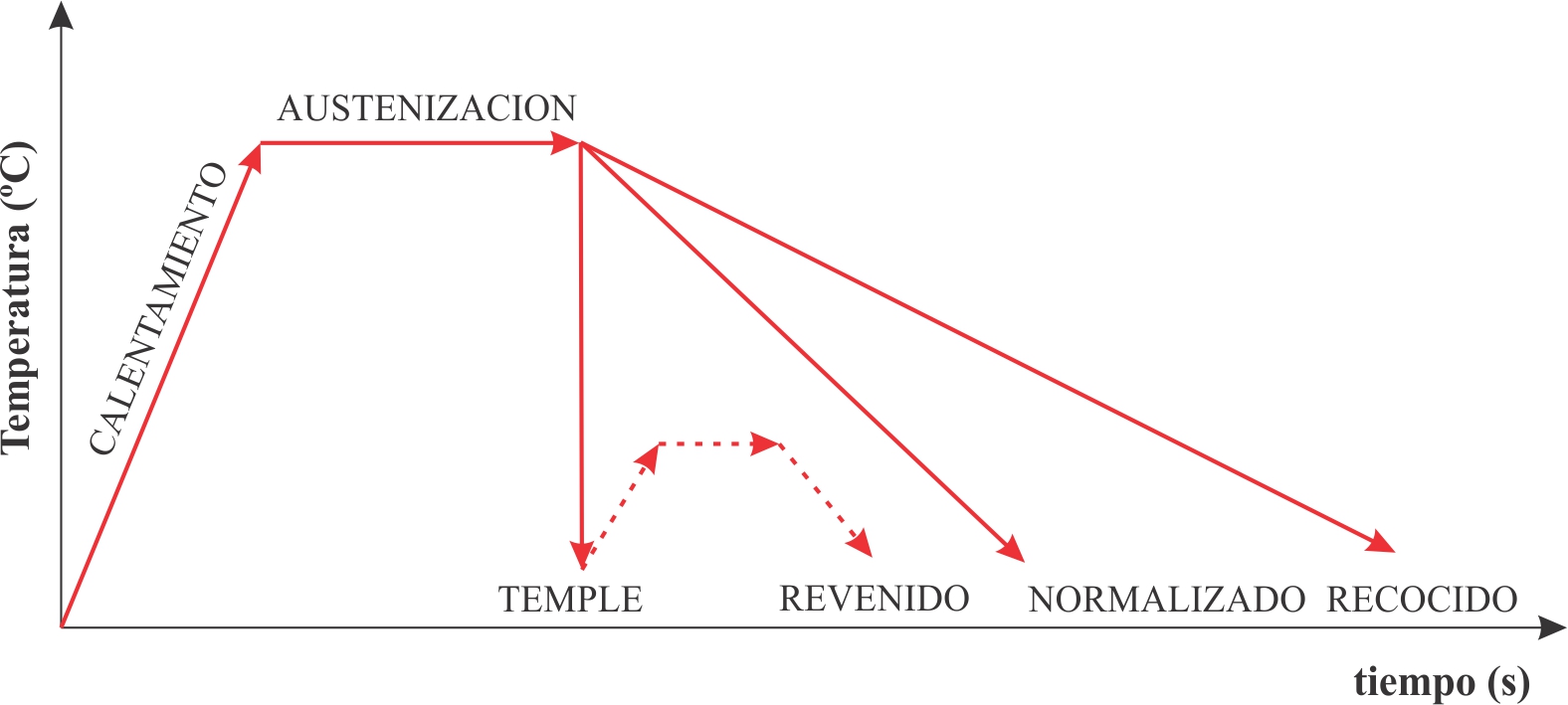
Figura 5. Tratamientos térmicos básicos
Tomado de (Derematerialia, 2022)Aprende más
En el siguiente video, se puede observar los tratamientos térmicos implementados en el acero: ¡Accede aquí!
ii. Sinterización
La sinterización es un proceso térmico utilizado en la fabricación de cerámicas y metales a partir de polvos. Implica calentar el material compactado a una temperatura inferior a su punto de fusión, pero suficientemente alta para permitir la difusión atómica. La ecuación de Arrhenius describe la tasa de sinterización:
Donde k es la constante de velocidad, A es el factor pre-exponencial, Ea es la energía de activación, R es la constante de los gases, y T es la temperatura absoluta.
b) Procesos mecánicos
Los procesos mecánicos implican la aplicación de fuerzas externas para cambiar la forma o propiedades de los materiales.
Conformado
El conformado incluye técnicas como:
- Forjado: Deformación del material mediante fuerzas compresivas.
- Laminado: Reducción del espesor del material pasándolo entre rodillos.
- Extrusión: Forzar el material a través de una matriz para crear formas de sección transversal constante.
La ecuación de flujo plástico describe el comportamiento del material durante el conformado:
Donde σ es el esfuerzo, K es el coeficiente de resistencia, ε es la deformación, y n es el exponente de endurecimiento por deformación.
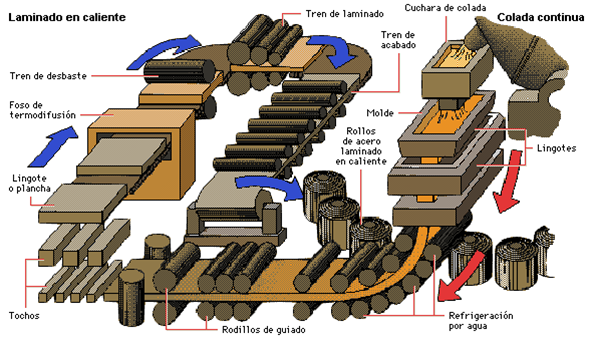
Figura 6. Proceso de Laminado en Caliente
Tomado de (Rojas, 2017)ii. Mecanizado
El mecanizado incluye procesos como torneado, fresado y taladrado. Estos procesos implican la remoción controlada de material para lograr formas y dimensiones específicas. La ecuación de Taylor para la vida útil de la herramienta en mecanizado es:
Donde V es la velocidad de corte, T es la vida útil de la herramienta, n es el exponente de Taylor, y C es una constante que depende del material y las condiciones de corte.
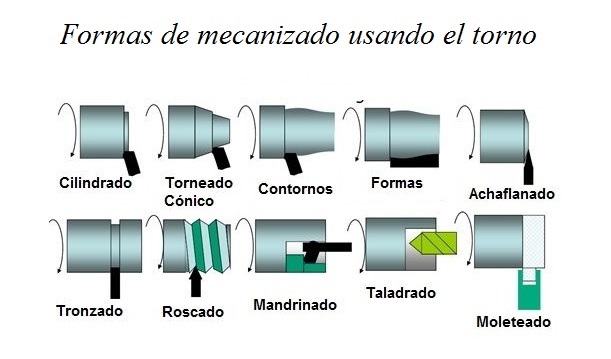
Figura 7. Procesos de mecanizado con torno
Tomado de (Galbarro, 2024)c) Procesos químicos
Los procesos químicos alteran la composición o estructura química de los materiales.
i. Electrodeposición
La electrodeposición es un proceso electroquímico utilizado para recubrir una superficie conductora con una capa de metal. La ley de Faraday describe la masa de material depositado:
Donde m es la masa depositada, Q es la carga eléctrica total pasada, M es la masa molar del material depositado, n es el número de electrones transferidos por ion, y F es la constante de Faraday.
ii. Anodizado
El anodizado es un proceso electroquímico que crea una capa de óxido protectora en la superficie de metales como el aluminio. El espesor de la capa anódica se puede estimar mediante la ley de Faraday modificada:
Donde d es el espesor de la capa, η es la eficiencia del proceso, I es la corriente, t es el tiempo, ρ es la densidad del óxido, y A es el área de la superficie.
4.2.2 Variables de proceso
El control preciso de las variables de proceso es esencial para obtener las propiedades deseadas en el producto final.
a) Temperatura
La temperatura afecta la cinética de las reacciones químicas y las transformaciones físicas. La ecuación de Arrhenius describe cómo la temperatura influye en la velocidad de reacción:
Donde k es la constante de velocidad, A es el factor pre-exponencial, es la energía de activación, R es la constante de los gases, y T es la temperatura absoluta.
b) Presión
La presión puede influir en la velocidad de las reacciones y en las transformaciones físicas. La ecuación de Clausius-Clapeyron describe cómo la presión afecta el punto de ebullición de un líquido:
Donde P1 y P2 son presiones, T1 y T2 son temperaturas correspondientes, es el calor latente de vaporización, y R es la constante de los gases.
c) Tiempo
El tiempo de exposición a ciertas condiciones puede afectar significativamente el resultado final de un proceso de transformación. La ecuación de Johnson-Mehl-Avrami-Kolmogorov (JMAK) describe la cinética de transformaciones de fase:
Donde X es la fracción transformada, k es la constante de velocidad, t es el tiempo, y n es el exponente de Avrami.
d) Composición química
La composición química del material y de cualquier aditivo o reactivo utilizado en el proceso puede influir en el resultado final de la transformación. La ley de Raoult describe cómo la composición afecta la presión de vapor de una solución ideal:
Donde P es la presión de vapor de la solución, X es la fracción molar del componente, y es la presión de vapor del componente puro.
e) Velocidad de enfriamiento o calentamiento
La velocidad de cambio de temperatura puede tener un impacto significativo en la estructura y propiedades finales del material. La ecuación de enfriamiento de Newton describe la tasa de cambio de temperatura:
Donde T es la temperatura del objeto, Ta es la temperatura ambiente, t es el tiempo, y k es la constante de enfriamiento.
4.2.3 Control de transformaciones
El control efectivo de las transformaciones de materiales es esencial para garantizar la calidad y consistencia de los productos finales, (Muroga et al., 2023).
a) Monitoreo en tiempo real
El uso de sensores y sistemas de monitoreo en tiempo real permite un control preciso de las variables de proceso. Por ejemplo, los termopares se utilizan para medir y controlar la temperatura en hornos industriales, siguiendo la ecuación de Seebeck:
Donde V es el voltaje generado, α es el coeficiente de Seebeck, y T1 y T2 son las temperaturas en las uniones del termopar.
b) Automatización y control de procesos
La implementación de sistemas automatizados y controlados por computadora permite una mayor precisión y repetibilidad. Los sistemas de control PID (Proporcional-Integral-Derivativo) son comunes en la industria, descritos por la ecuación:
Donde u(t) es la señal de control, e(t) es el error, y Kp, Ki, y Kd son las constantes proporcional, integral y derivativa, respectivamente.
c) Análisis postproceso
La realización de pruebas y análisis después del proceso de transformación es crucial para verificar que se han alcanzado las propiedades deseadas. Esto puede incluir ensayos de dureza, análisis metalográficos o pruebas de resistencia mecánica.
d) Optimización de procesos
La mejora continua de los procesos de transformación mediante técnicas de optimización y diseño de experimentos puede llevar a una mayor eficiencia y calidad en la producción de materiales.
El control preciso de los procesos de transformación de materiales es fundamental para la ingeniería de materiales moderna, permitiendo la producción de materiales con propiedades específicas y de alta calidad para diversas aplicaciones industriales y tecnológicas.
-
Profundiza más
Este recurso te ayudará a enfatizar sobre el tema ¡Accede aquí!
-
-
-
Hacer un envío
-
Hacer intentos: 1
-
-
Hacer un envío
-
Hacer intentos: 1